(59)いまさら聞けない「pHとpKa」
いまさらですが、pHの説明から始めます。
IUPACやJISでは、pHを溶液の水素イオンの活量(aH+)で定義しています(式1)。しかし、希薄水溶液の水素イオンの活量係数は1として差し支えないので、水素イオン濃度[H+]からpHを計算します(式2)。私たちがよく目にするのはこの式です。なお、logは全て常用対数です。
pH =-log aH+ (1)
pH =-log [H+] (2)
例えば、0.01 mol/L塩酸水溶液は、[H+]=1×10-2 mol/LでpH 2です。
pH 2の硫酸水溶液は0.005 mol/Lです。説明不要でしょうが、硫酸は 2価の強酸(H2SO4→2H+ + SO42—)なので、水素イオン濃度[H+]=0.01 mol/Lとなる希薄硫酸溶液濃度は0.005 mol/Lです(式3)。
[H+] = 酸の価数×酸の電離度×酸のモル濃度= 2×1×0.005 = 0.01 (mol/L) (3)
0.01 mol/L水酸化ナトリウム水溶液も完全に電離(NaOH→Na+ + OH— )しています。この水溶液の水素イオン濃度は、水のイオン積Kw(式4)から求めることができ、式5のとおり[H+] = 1.0×10—12 mol/L、pH 12となります。
Kw = [H+][OH—]=1.0×10—14 (mol/L) (4)
[H+] = 1.0×10—14 /[OH—] = 1.0×10—14 /1.0×10—2 = 1.0×10—12 (mol/L) (5)
弱酸性物質(HA)は、水溶液中で分子形とイオン形が共存しています(HA ⇄ H+ + A—)。
このときの平衡定数Kaは式6で表されますが、それを式7の形にしたものが酸解離定数pKaです。pKaは酸の強さ(水素イオンの解離しやすさ)を定量的にあらわす指標です
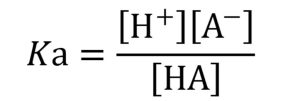 (6)
(6)
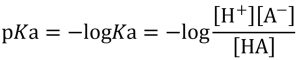 (7)
(7)
弱酸性物質のpHは式8で求められます。
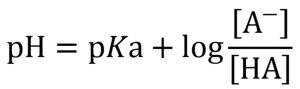 (8)
(8)
例えば、酢酸の水溶液で酢酸イオン濃度と酢酸濃度が等しいとき、[A—]/[HA] = [CH3COO—]/[CH3COOH] =1です。このときの酢酸水溶液のpHはpKaとなります。
弱酸或いは弱塩基のpKa は、緩衝領域中心のpHとなります。
最後に、一般的な酸・塩基の電離度を表に示しておきます。
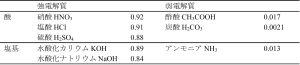
表 酸・塩基の電離度(25 ℃、0.1 mol/L水溶液)1)
【引用文献】
1) 中村 洋監修、日本分析化学会液体クロマトグラフィー研究懇談会、液クロ龍の巻、pp.15-16、筑波出版社 (2004).