(61)トリフルオロ酢酸のpHは酢酸よりなぜ低いのか
前回、共鳴効果が化合物の酸性度に与える影響について説明しました。
酸性度に影響を与える因子として、「誘起効果」というものもあります。誘起効果は電子求引性誘起効果ともよばれます。
電子求引性基は、酸の共役塩基(酸がH+を放出し、分子はマイナスに電荷している状態)の負電荷を、分子全体に非局在化させ安定化させます。強い電子求引性基が結合している化合物や電子求引性基が多く結合している化合物の酸性度が高くなります。つまり強酸性になります。
例えば、酢酸のメチル基に電子求引性基である塩素が一つ置換したクロロ酢酸は、誘起効果で酢酸よりも酸性度が高くなります。塩素が電子を引っ張った結果、電離後のカルボキシル基(-COO-)が安定となるイメージです。
塩素よりも電気陰性度の大きいフッ素が結合すると、同じ位置に塩素が結合しているものよりも、さらに酸性度が高くなります。クロロ酢酸よりもフルオロ酢酸のほうが低いpHとなります。もちろん、その電子求引性基の数が多いほうが酸性度は高くなります。トリフルオロ酢酸のpKaは0.23です。
ニトロ基(-NO2)やメトキシ基(-OCH3)も電子求引性基で、誘起効果の大きさはニトロ基>ハロゲン>メトキシ基の順となります。
反対にアルキル基のような電子供与性基がある場合、共役塩基の安定性が減少し酸性度も下がります。
表に誘起効果による酸性度の違いをまとめました。
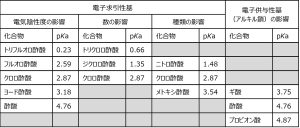
誘起効果が酸性度に与える影響1)
【引用文献】
1) Haynes W. M. eds. CRC Handbook of Chemistry and Physics, 97th Edition 2016-2017, pp.5-88 – 97, CRC Press (2016).


